Page 55 - Chernik
P. 55
DOI: https://doi.org/10.15414/2020.9788055222776
Черник М., Войналович Н., Сиренко Е., Пилипко Е. ‒ Патологии пчёл
извлекались из сота, их с трудом удавалось перерезать (поверхность излома была
однородной). Личинки, поражённые мицелием гриба мужского пола, имели
желтовато-белый окрас, женского пола – белый, а поражённые обоими полами –
грязно-серый оттенок. Перга в ячейках напоминала мумифицированный расплод,
однако она имела мягкую консистенцию и легко резалась, а поверхность среза
имела концентрическое строение.
Проведение микологического исследования включало в себя микроскопию
первичного материала и выращенных на питательных средах чистых культур. Для
микроскопии первичного материала осуществляли соскоб налета мицелия с
поверхности поражённых личинок, отобранных для микроскопического
исследования. Затем помещая соскоб на предметное стекло делали препарат
«раздавленная капля», нанося каплю смеси, состоящей из 50 % водного раствора
глицерина, воды и спирта в соотношении 1:1:1. Исследование проводили под
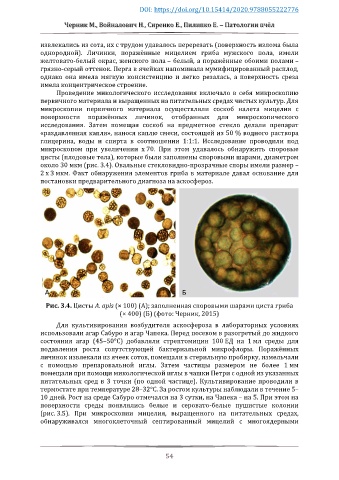
микроскопом при увеличении х 70. При этом удавалось обнаружить споровые
цисты (плодовые тела), которые были заполнены споровыми шарами, диаметром
около 30 мкм (рис. 3.4). Овальные стекловидно-прозрачные споры имели размер –
2 x 3 мкм. Факт обнаружения элементов гриба в материале давал основание для
постановки предварительного диагноза на аскосфероз.
Рис. 3.4. Цисты A. apis (× 100) (А); заполненная споровыми шарами циста гриба
(× 400) (Б) (фото: Черник, 2015)
Для культивирования возбудителя аскосфероза в лабораторных условиях
использовали агар Сабуро и агар Чапека. Перед посевом в разогретый до жидкого
состояния агар (45–50°С) добавляли стрептомицин 100 ЕД на 1 мл среды для
подавления роста сопутствующей бактериальной микрофлоры. Поражённых
личинок извлекали из ячеек сотов, помещали в стерильную пробирку, измельчали
с помощью препаровальной иглы. Затем частицы размером не более 1 мм
помещали при помощи микологической иглы в чашки Петри с одной из указанных
питательных сред в 3 точки (по одной частице). Культивирование проводили в
термостате при температуре 28–32°С. За ростом культуры наблюдали в течение 5–
10 дней. Рост на среде Сабуро отмечался на 3 сутки, на Чапека – на 5. При этом на
поверхности среды появлялись белые и серовато-белые пушистые колонии
(рис. 3.5). При микроскопии мицелия, выращенного на питательных средах,
обнаруживался многоклеточный септированный мицелий с многоядерными
54